
- Autorius Stanley Ellington [email protected].
- Public 2023-12-16 00:20.
- Paskutinį kartą keistas 2025-01-22 16:05.
Klinikinių tyrimų paraiška ( CTA ) yra paraiška / pateikimas kompetentingam nacionaliniam asmeniui. Reguliavimo Institucija (-os), suteikianti (-os) leidimą atlikti klinikinį tyrimą konkrečioje šalyje. Pavyzdžiai. pareiškimus kompetentingai nacionalinei Reguliavimo Institucijos gali apimti, bet tuo neapsiribojant: 1.
Kalbant apie tai, kas yra CTA klinikiniuose tyrimuose?
A Klinikinis tyrimas susitarimas ( CTA ) yra teisiškai įpareigojantis susitarimas, kuriuo valdomi santykiai tarp rėmėjo, kuris gali teikti studijuoti vaistas ar prietaisas, finansinė parama ir (arba) patentuota informacija ir institucija, kuri gali teikti duomenis ir (arba) rezultatus, paskelbti, įvesti į tolesnę informaciją
Panašiai, kas patvirtina klinikinius tyrimus JK? Teismo procesas leidimas Visi klinikiniai tyrimai vaistų ir medicinos prietaisų tyrimų taip pat turi gauti organizacijos, vadinamos Vaistų ir sveikatos priežiūros produktų reguliavimo agentūra (MHRA), leidimą. Tai vadinama Klinikinis tyrimas Autorizacija (CTA).
Vėliau kyla klausimas, kas yra CTA farmacijoje?
Klinikinių tyrimų patvirtinimai ( CTA ); (IND) Procedūra apima EudraCT numerio gavimą iš Europos vaistų agentūros (EMA) ir paraiškos dėl leidimo atlikti klinikinį tyrimą pateikimą. CTA ) kiekvienos valstybės narės, kurioje bus atliekamas tyrimas, kompetentingai institucijai.
Ar Inds patvirtintas?
IND nėra rinkodaros programa patvirtinimas . Tai yra kelias, kuriuo rėmėjas iš Maisto ir vaistų administracijos (FDA) gauna išimtį nuo federalinio įstatymo, draudžiančio nepatvirtinto vaisto gabenimą per valstybės sienas.
Rekomenduojamas:
Kas yra sandėlyje ir kas yra sandėlyje?
Sandėlyje/nėra. frazė. Jei prekių yra sandėlyje, parduotuvėje jas galima parduoti. Jei jų nėra, tai nėra
Kas yra hipotekos davėjas ir kas yra hipotekos kreditorius?

Hipotekos kreditorius yra subjektas, kuris skolina pinigus paskolos gavėjui nekilnojamojo turto įsigijimui. Hipotekos skolinimo sandoryje skolintojas yra hipotekos gavėjas, o skolininkas yra žinomas kaip hipotekos davėjas
Kas yra CTA farmacijoje?

Klinikinių tyrimų patvirtinimai (CTA); (IND) Procedūra apima EudraCT numerio gavimą iš Europos vaistų agentūros (EMA) ir paraiškos dėl leidimo atlikti klinikinį tyrimą (CTA) pateikimą kiekvienos valstybės narės, kurioje bus atliekamas tyrimas, kompetentingai institucijai
Kas yra urbanizacija ir kokios yra jos priežastys?
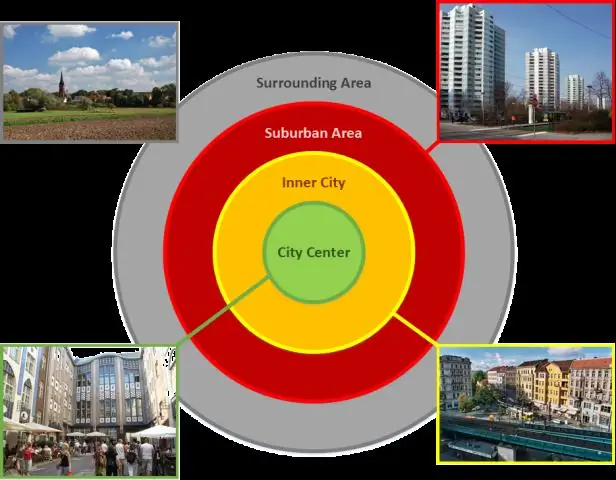
Urbanizacija vyksta daugiausia dėl to, kad žmonės iš kaimo vietovių persikelia į miesto vietoves, o dėl to didėja miesto gyventojų skaičius ir miestų teritorijos. Šie gyventojų skaičiaus pokyčiai lemia kitus žemės naudojimo, ekonominės veiklos ir kultūros pokyčius
Kas yra alternatyvieji kaštai ir kokia yra ekonominė nauda?

Kas yra alternatyvioji kaina? Alternatyvūs kaštai atspindi naudą, kurios asmuo, investuotojas ar įmonė praranda, kai pasirenka vieną alternatyvą, o ne kitą. Nors finansinėse ataskaitose nepateikiamos alternatyvios išlaidos, verslo savininkai gali ja pasinaudoti priimdami pagrįstus sprendimus, kai prieš juos turi kelios galimybės
